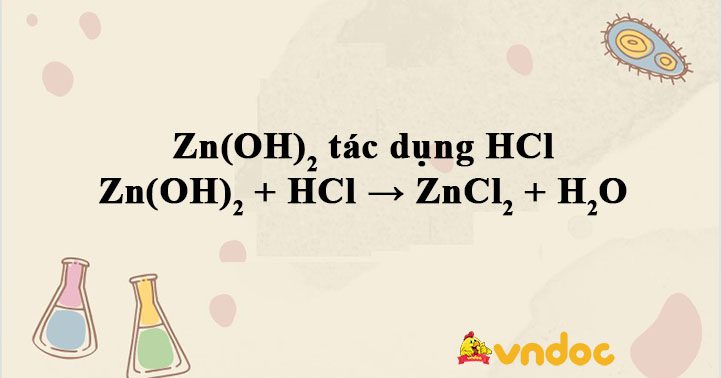
Zn(OH)2 + HCl → ZnCl2 + H2O được TaiLieuViet biên soạn hướng dẫn bạn đọc viết và cân bằng phương trình phản ứng khi cho Zn(OH)2 tác dụng HCl, Zn(OH)2 là hidroxit lưỡng tính có thể tác dụng được với cả dung dịch kiềm và axit. Mời các bạn tham khảo.
Mục Lục
Toggle1. Phương trình phản ứng Zn(OH)2 tác dụng NaOH
2. Phương trình ion rút gọn Zn(OH)2+ HCl
Phương trình ion rút gọn
3. Điều kiện phản ứng Zn(OH)2 tác dụng HCl
Không có
4. Hiện tượng phản ứng Zn(OH)2 tác dụng HCl
Đem hòa tan vào dung dịch HCk dư, thấy chất rắn tan dần
5. Bài tập vận dụng liên quan
Câu 1. Dãy các hợp chất nào sau đây tan được trong nước nhưng không tan trong dung dịch HCl
A. CuS, Ca3(PO4)2, CaCO3.
B. AgCl, BaSO3, Cu(OH)2.
C. BaCO3, Fe(OH)3, FeS.
D. BaSO4, FeS2, ZnO.
Dãy các hợp chất nào sau đây tan được trong nước nhưng không tan trong dung dịch HCl
BaCO3, Fe(OH)3, FeS
Câu 2. Dãy chất nào sau đây phản ứng được với dung dịch HCl
A. CaCO3, ZnO, Zn(OH)2, Zn
B. Cu, CaO, SO2, Al
C. Ag, MgO, NaOH, SO2
D. SO2, Na2O, KOH, NaBr
Loai B vì Cu, SO2 không phản ứng với dung dịch HCl
Loại C vì Ag, SO2 không phản ứng với dung dịch HCl
Loại D vì SO2 không phản ứng với dung dịch HCl
Dãy chất nào sau đây phản ứng được với dung dịch HCl
A. CaCO3, ZnO, Zn(OH)2, Zn
Phương trình phản ứng minh họa
CaCO3 + 2HCl → H2O + CO2↑ + CaCl2
ZnO + 2HCl → ZnCl2 + H2O
Zn(OH)2 + 2HCl → ZnCl2 + H2O
Zn + 2HCl → ZnCl2 + H2
Câu 3. Cặp dung dịch nào sau đây phản ứng với nhau tạo ra chất khí?
A. NH4Cl và AgNO3.
B. Zn(OH)2 và NaOH
C. Na2CO3 và HCl.
D. Na2CO3 và KOH.
A. NH4Cl và AgNO3.
NH4Cl + AgNO3 → NH4NO3 + AgCl↓
B. Zn(OH)2 và NaOH
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
C. Na2CO3 và HCl.
Na2CO3 + 2HCl → 2NaCl + CO2+ H2O
D. Na2CO3 và KOH.
Không phản ứng
Câu 4. Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
A. H2SO4, Zn(NO3)2, CaCl2, H2S
B. AgCl, CH3COOH, Fe(NO3)3, Zn(OH)2
Dãy chất trong nước đều là chất điện li mạnh: HNO3, CaCl2, AlCl3, Ba(OH)2
Câu 5. Cho Zn dư vào dung dịch AgNO3, Cu(NO3)2, Fe(NO3)3. Số phản ứng hoá học xảy ra là:
A. 1.
B. 2.
C. 3.
D. 4.
Phương trình phản ứng minh họa
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Zn + Fe(NO3)2 → Zn(NO3)2 + Fe
Câu 6. Cho các phản ứng:
(1) Zn + 2HCl → ZnCl2 + H2
(2) 2KOH + (NH4)2SO4 → K2SO4 + 2NH3 + 2H2O
(3) CaCl2 + Na2CO3 → CaCO3 + 2NaCl
(4) 2NH3 + 2H2O + FeSO4 → Fe(OH)2 + (NH4)2SO4
Các phản ứng thuộc loại phản ứng axit – bazơ là
A. (2), (4).
B. (3), (4).
C. (2), (3).
D. (1), (2).
Các phản ứng thuộc loại axit – bazơ là phản ứng có chất cho proton và chất nhận proton mà ko có sự thay đổi số oxi hóa
(2) 2KOH + (NH4)2SO4 → K2SO4 + 2NH3 + 2H2O
(4) 2NH3 + 2H2O + FeSO4 → Fe(OH)2 + (NH4)2SO4
Câu 7. Dãy gồm những chất hiđroxit lưỡng tính là
A. Ca(OH)2, Pb(OH)2, Zn(OH)2
B. Ba(OH)2, Al(OH)3, Sn(OH)2
C. Zn(OH)2, Al(OH)3, Sn(OH)2
D. Fe(OH)3, Mg(OH)2, Zn(OH)2
A. Sai vì Ca(OH)2 là bazơ
B. Sai vì Ba(OH)2 là bazơ
D. SaiI vì Fe(OH)3 và Mg(OH)2 là bazơ
Vậy Dãy gồm những chất hiđroxit lưỡng tính là Zn(OH)2, Al(OH)3, Sn(OH)2
Câu 8. Chất nào sau đây là hiđroxit lưỡng tính?
A. Mg(OH)2
B. Zn(OH)2
C. NaOH
D. Fe(OH)2
Chất là hiđroxit lưỡng tính là ZN(OH)2, ngoài ra một số hiđroxit lưỡng tính thường gặp như: Al(OH)3, Sn(OH)2, Cr(OH)3, Pb(OH)2, hidroxit lưỡng tính là hiđro khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
………………………………….
>> Mời các bạn tham khảo thêm một số phương trình liên quan:
- Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O
- Zn + HCl → ZnCl2 + H2
- Zn + CuSO4 → ZnSO4 + Cu
- Zn + NaOH + H2O → Na2[Zn(OH)4] + H2
- ZnO + H2SO4 → ZnSO4 + H2O
- ZnO + NaOH → Na2ZnO2 + H2O
Trên đây TaiLieuViet.vn vừa giới thiệu tới các bạn bài viết Zn(OH)2 + HCl → ZnCl2 + H2O, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11…
Related posts
Tài liệu nổi bật
Categories
- Âm Nhạc – Mỹ Thuật Lớp 9 (17)
- Âm nhạc lớp 6 – KNTT (31)
- Âm Nhạc Lớp 7- CTST (23)
- Bài tập Toán 9 (8)
- Chưa phân loại (32)
- Chuyên đề Hóa học 12 (196)
- Chuyên đề Sinh học lớp 12 (61)
- Chuyên đề Toán 9 (50)
- Công Nghệ Lớp 10- CD (58)
- Công Nghệ Lớp 10- KNTT (52)
- Công nghệ Lớp 11 – KNTT (22)
- Công Nghệ Lớp 6 – CTST (15)
- Công Nghệ Lớp 6 – KNTT (16)
- Công Nghệ Lớp 7- CTST (18)
- Công Nghệ Lớp 7- KNTT (19)
- Công nghệ Lớp 8 – CD (21)
- Công nghệ Lớp 8 – CTST (18)
- Công nghệ Lớp 8 – KNTT (7)
- Công Nghệ Lớp 9 (114)
- Đề thi học kì 2 lớp 9 môn Văn (35)
- Địa Lí Lớp 10- CD (99)
- Địa Lí Lớp 10- KNTT (77)
- Địa lí Lớp 11 – CD (31)
- Địa lí Lớp 11 – CTST (23)
- Địa lí Lớp 11 – KNTT (19)
- Địa Lí Lớp 12 (134)
- Địa lí Lớp 6 – CTST (36)
- Địa lí Lớp 6 – KNTT (30)
- Địa Lí Lớp 7- CTST (22)
- Địa Lí Lớp 7- KNTT (19)
- Địa Lí Lớp 9 (290)
- GDCD 12 (28)
- GDCD Lớp 6 – CTST (8)
- GDCD Lớp 6 – KNTT (12)
- GDCD Lớp 9 (94)
- Giải bài tập Địa Lí 12 (12)
- Giải bài tập SGK Toán 12 (8)
- Giải bài tập Sinh học 12 (45)
- Giải SBT Hóa học 12 (71)
- Giải vở BT Văn 9 (122)
- Giáo Dục Công Dân Lớp 7- CTST (12)
- Giáo Dục Công Dân Lớp 7- KNTT (10)
- Giáo dục công dân Lớp 8 – CD (10)
- Giáo dục công dân Lớp 8 – CTST (10)
- Giáo dục công dân Lớp 8 – KNTT (10)
- Giáo Dục Quốc Phòng Lớp 10- CD (12)
- Giáo Dục Quốc Phòng Lớp 10- KNTT (12)
- Hóa Học Lớp 10- CD (30)
- Hóa Học Lớp 10- KNTT (61)
- Hoá Học Lớp 11 – CD (19)
- Hoá học Lớp 11 – CTST (19)
- Hoá học Lớp 11 – KNTT (25)
- Hóa Học Lớp 12 (130)
- Hóa Học Lớp 9 (717)
- Hoạt Động Trải Nghiệm Lớp 10- KNTT (52)
- Hoạt Động Trải Nghiệm Lớp 7- CTST (40)
- Hoạt Động Trải Nghiệm Lớp 7- KNTT (16)
- Hoạt động trải nghiệm Lớp 8 – CD (19)
- Hoạt động trải nghiệm Lớp 8 – CTST (9)
- Hoạt động trải nghiệm Lớp 8 – KNTT (18)
- Khoa học tự nhiên Lớp 6 – CTST (46)
- Khoa học tự nhiên Lớp 6 – KNTT (57)
- Khoa Học Tự Nhiên Lớp 7- CTST (51)
- Khoa học tự nhiên Lớp 8 – CD (51)
- Khoa học tự nhiên Lớp 8 – CTST (33)
- Khoa học tự nhiên Lớp 8 – KNTT (37)
- Kinh Tế & Pháp Luật Lớp 10 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CTST (11)
- Kinh tế & Pháp luật Lớp 11 – KNTT (11)
- Lịch Sử Lớp 10- CD (34)
- Lịch Sử Lớp 10- CTST (20)
- Lịch Sử Lớp 10- KNTT (42)
- Lịch sử Lớp 11 – CTST (13)
- Lịch sử Lớp 11 – KNTT (13)
- Lịch sử Lớp 6 – CTST (21)
- Lịch sử Lớp 6 – KNTT (22)
- Lịch Sử Lớp 7- CTST (19)
- Lịch sử lớp 7- KNTT (18)
- Lịch Sử Lớp 9 (148)
- Lịch sử và Địa lí Lớp 8 – CTST (40)
- Lịch sử và Địa lí Lớp 8 – KNTT (33)
- Lý thuyết Địa lý 12 (4)
- Lý thuyết Lịch sử lớp 9 (33)
- Lý thuyết Ngữ Văn (83)
- Lý thuyết Ngữ Văn 12 (18)
- Lý thuyết Sinh học 12 (41)
- Mở bài – Kết bài hay (55)
- Mở bài lớp 12 hay (24)
- Nghị luận xã hội (34)
- Ngữ Văn Lớp 10- CD (113)
- Ngữ Văn Lớp 10- CTST (79)
- Ngữ Văn Lớp 10- KNTT (198)
- Ngữ Văn Lớp 11 – CD (51)
- Ngữ văn Lớp 11 – CTST (89)
- Ngữ Văn Lớp 11 – KNTT (107)
- Ngữ Văn Lớp 12 (379)
- Ngữ Văn Lớp 6 – KNTT (293)
- Ngữ Văn Lớp 7- CTST (103)
- Ngữ Văn Lớp 7- KNTT (66)
- Ngữ văn Lớp 8 – CD (48)
- Ngữ văn Lớp 8 – CTST (123)
- Ngữ văn Lớp 8 – KNTT (196)
- Ngữ Văn Lớp 9 (28)
- Phân tích các tác phẩm lớp 12 (12)
- Sinh Học Lớp 10- CD (49)
- Sinh Học Lớp 10- CTST (61)
- Sinh Học Lớp 10- KNTT (71)
- Sinh Học Lớp 11 – CD (16)
- Sinh học Lớp 11 – CTST (18)
- Sinh học Lớp 11 – KNTT (18)
- Sinh Học Lớp 9 (229)
- Soạn Anh 12 mới (86)
- Soạn văn 9 (50)
- SOẠN VĂN 9 BÀI 1 (50)
- SOẠN VĂN 9 BÀI 2 (50)
- Tác giả – Tác phẩm (41)
- Tác giả – Tác phẩm Ngữ Văn 12 (13)
- Thi THPT QG môn Địa lý (12)
- Thi THPT QG môn Sinh (8)
- Tiếng Anh Lớp 10 Friends Global (57)
- Tiếng Anh Lớp 10 Global Success (604)
- Tiếng Anh Lớp 10 iLearn Smart World (98)
- Tiếng anh Lớp 11 Friends Global (171)
- Tiếng anh Lớp 11 Global Success (368)
- Tiếng anh Lớp 11 iLearn Smart World (104)
- Tiếng Anh Lớp 12 cũ (168)
- Tiếng Anh Lớp 6 Friends Plus (114)
- Tiếng Anh Lớp 6 Global Success (174)
- Tiếng Anh Lớp 7 Friends Plus (160)
- Tiếng Anh Lớp 8 Friends plus (71)
- Tiếng anh Lớp 8 Global Success (79)
- Tiếng anh Lớp 8 iLearn Smart World (40)
- Tiếng Anh Lớp 9 Mới (211)
- Tin Học Lớp 10- CD (24)
- Tin Học Lớp 10- KNTT (33)
- Tin học Lớp 11 – KNTT (21)
- Tin Học Lớp 6 – CTST (41)
- Tin Học Lớp 6- KNTT (17)
- Tin Học Lớp 7- CTST (14)
- Tin Học Lớp 7- KNTT (16)
- Tin học Lớp 8 – CD (36)
- Tin học Lớp 8 – CTST (10)
- Tin học Lớp 8 – KNTT (5)
- Tin Học Lớp 9 (21)
- Toán 10 sách Chân trời sáng tạo (42)
- Toán Lớp 1 – KNTT (1)
- Toán Lớp 10- CD (44)
- Toán Lớp 10- CTST (39)
- Toán Lớp 10- KNTT (161)
- Toán Lớp 11 – CD (19)
- Toán Lớp 11 – CTST (44)
- Toán Lớp 11 – KNTT (46)
- Toán Lớp 12 (123)
- Toán Lớp 6 – CTST (62)
- Toán Lớp 6 – KNTT (102)
- Toán Lớp 7- CTST (52)
- Toán Lớp 7- KNTT (74)
- Toán Lớp 8 – CD (23)
- Toán Lớp 8 – CTST (21)
- Toán Lớp 8 – KNTT (34)
- Toán Lớp 9 (194)
- Tóm tắt Ngữ văn (16)
- Trắc nghiệm Ngữ Văn (75)
- Trắc nghiệm Toán 9 (61)
- Trải nghiệm hướng nghiệp Lớp 11 – KNTT (8)
- Văn mẫu 12 phân tích chuyên sâu (12)
- Văn mẫu 9 (273)
- Vật Lí Lớp 10- CD (39)
- Vật Lí Lớp 10- KNTT (61)
- Vật Lí Lớp 11 – CD (18)
- Vật lí Lớp 11 – CTST (20)
- Vật lí Lớp 11 – KNTT (26)
- Vật Lý Lớp 9 (217)