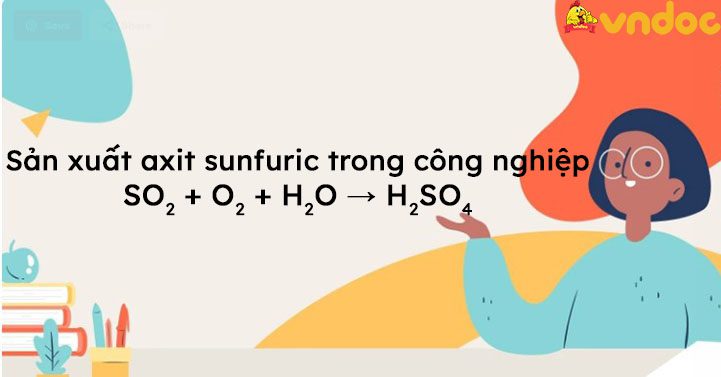
SO2 + O2 + H2O → H2SO4 được TaiLieuViet biên soạn là phương trình từ lưu huỳnh đoxit tạo ra axit H2SO4. Đây cũng là một trong các phản ứng điều chế sản xuất axit sunfuric trong công nghiệp. Hy vọng tài liệu này sẽ giúp các bạn học sinh viết và cân bằng phương trình một cách nhanh và chính xác nhất.
Mục Lục
Toggle1. Phương trình hóa học SO2 ra H2SO4
2. Sản xuất H2SO4 trong công nghiệp
Axít sulfuric được sản xuất từ lưu huỳnh, oxi và nước theo công nghệ tiếp xúc.
Trong giai đoạn đầu lưu huỳnh bị đốt để tạo ra đioxít lưu huỳnh.
(1) S(r) + O2(k) ![]() SO2(k)
SO2(k)
Sau đó nó bị ôxi hóa thành triôxít lưu huỳnh bởi oxi với sự có mặt của V2O5 ở nhiệt độ 450oC)
(2) 2SO2 + O2(k) ![]() 2SO3(k)
2SO3(k)
Cuối cùng triôxít lưu huỳnh được xử lý bằng nước (trong dạng 97-98% H2SO4 chứa 2-3% nước) để sản xuất axít sulfuric 98-99%.
(3) SO3(k) + H2O(l) → H2SO4(l)
3. Tính chất hóa học của SO2
3.1. Lưu huỳnh đioxit tác dụng với nước
SO2 + H2O ⇋ H2SO3
3.2. Lưu huỳnh đioxit tác dụng với dung dịch bazơ
(có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
3.3. Lưu huỳnh đioxit tác dụng với oxit bazơ → muối
SO2 + CaO → CaSO3
3.4. SO2 vừa là chất khử, vừa là chất oxi hóa
(do S trong SO2 có mức oxi hóa trung gian +4)
3.5. Lưu huỳnh đioxit là chất oxi hóa
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
4. Bài tập liên quan sản xuất H2SO4 trong công nghiệp
Câu 1. Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí là
A. Na2SO3, CaCO3, Zn.
B. Al, MgO, KOH.
C. BaO, Fe, CaCO3.
D. Zn, Fe2O3, Na2SO3.
A.
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Zn + H2SO4 → ZnSO4 + H2
B.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
H2SO4 + MgO → H2O + MgSO4
H2SO4 + 2KOH → 2H2O + K2SO4
Loại vì có 2 phản ứng với MgO và KOH không sinh ra khí
C.
BaO + H2SO4 → H2O + BaSO4
Fe + H2SO4 → H2 + FeSO4
CaCO3 + H2SO4 → H2O + CO2 + CaSO4
→ Loại vì có 2 phản ứng với BaO không sinh ra khí
D.
H2SO4 + Zn → H2 + ZnSO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
→ Loại vì có phản ứng với Fe2O3 không sinh ra khí
Câu 2. Cho các phát biểu sau:
(a) Axit sunfuric là chất lỏng, sánh như dầu, không màu, không bay hơi,
(b) Axit sunfuric tan vô hạn trong nước, và tỏa rất nhiều nhiệt,
(c) Khi pha loãng axit sunfuric đặc, ta cho nhanh nước vào axit và khuấy nhẹ
(d) Axit sunfuric đặc có tính háo nước, khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng..
B. 2
C. 3
D. 5
Phát biểu đúng là (a), (b), (d) (e) (có 4 phát biểu đúng)
Phát biểu (c) sai vì khi pha loãng axit sunfuric đặc, ta cho từ từ axit vào nước và khuấy nhẹ.
Câu 3. Các khí nào sau đây đều làm mất màu dung dịch brom?
A. SO2, H2S, N2
B. SO2, H2S
C. SO2, CO2, H2S
D. SO2, CO2
SO2 + Br2 + H2O → HBr + H2SO4
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
Câu 4. Kim loại nào sau đây không tác dụng với dung dịch H2SO4loãng?
A. Al
B. Mg
C. Na
D. Cu
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Mg + H2SO4 loãng → MgSO4 + H2
2Na + 2H2SO4 → Na2SO4 + SO2 + 2H2O
Câu 5. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Cu
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Mg + H2SO4 loãng → MgSO4 + H2
Fe + H2SO4 loãng → FeSO4 + H2
Câu 6. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4đặc, nguội?
A. Al, Fe, Au, Mg
B. Zn, Pt, Au, Mg
C. Al, Fe, Zn, Mg
D. Al, Fe, Au, Pt
Câu 7. Cho phương trình hóa học:
aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O
Tỉ lệ a:b là
A.1:1
B. 2:3
C. 1:3
D. 1:2
Câu 8. Phương trình hóa học nào sau đây không đúng?
A. Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O
B. Fe + S ![]() FeS
FeS
C. 2Ag + O3![]() Ag2O + O2
Ag2O + O2
D. 2Fe + 3H2SO4(loãng) → Fe2(SO4)3+ 3H2
Câu 9. Nguyên tố lưu huỳnh có số hiệu nguyên tử là 16. Vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA.
B. chu kì 5, nhóm VIA.
C. chu kì 3, nhóm IVA.
D. chu kì 5, nhóm IVA.
Cấu hình electron nguyên tử S là: 1s22s22p63s23p4.
→ Lưu huỳnh ở chu kỳ 3 (do có 3 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p).
Câu 10. Cho các phản ứng hóa học sau:
S + O2 ![]() SO2
SO2
S + 3F2![]() SF6
SF6
S + Hg → HgS
S + 6HNO3 (đặc)![]() H2SO4 + 6NO2 + 2H2O
H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Câu 11. Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Câu 12. Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. 4S + 6NaOH (đặc) ![]() 2Na2S + Na2S2O3 +3H2O
2Na2S + Na2S2O3 +3H2O
B. S + 3F2![]() SF6
SF6
C. S + 6HNO3 (đặc)![]() H2SO4 + 6NO2 + 2H2O
H2SO4 + 6NO2 + 2H2O
D. S + 2Na ![]() Na2S
Na2S
Câu 13. Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Mg + S → MgS
nMg = 0,2 (mol); nS =0,3 (mol) => S dư; nMgS = 0,2 (mol)
MgS + 2HCl → MgCl2 + H2S ↑
=> V = 0,2.22,4 = 4,48 (lít)
Câu 14. Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí là
A. K2SO3, BaCO3, Zn.
B. Al, ZnO, KOH.
C. CaO, Fe, BaCO3.
D. Zn, Fe2O3, Na2SO3.
A.
K2SO3 + H2SO4 → K2SO4 + SO2 + H2O
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
Zn + H2SO4 → ZnSO4 + H2
B.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
H2SO4 + ZnO → H2O + ZnSO4
H2SO4 + 2NaOH → 2H2O + Na2SO4
→ Loại vì có 2 phản ứng với MgO và KOH không sinh ra khí
C.
CaO + H2SO4 → H2O + CaSO4
Fe + H2SO4 → H2 + FeSO4
BaCO3 + H2SO4 → H2O + CO2 + BaSO4
→ Loại vì có 2 phản ứng với BaO không sinh ra khí
D.
H2SO4 + Zn → H2 + ZnSO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
→ Loại vì có phản ứng với Fe2O3 không sinh ra khí
Câu 15. Dung dịch A tác dụng với CuO tạo ra dung dịch có màu xanh lam. A là
A. KOH
B. Na2CO3
C. H2SO4
D. Ca(OH)2
CuO là oxit bazơ => tan trong dung dịch axit H2SO4 tạo muối CuSO4 có màu xanh lam
CuO + H2SO4 → CuSO4 + H2O
Mời các bạn tham khảo đầy đủ bộ câu hỏi trắc nghiệm axit H2SO4 tại:
- Trắc nghiệm Hóa học 10 bài 33: Axit sunfuric – Muối sunfat
- S + H2SO4 → SO2 + H2O
- FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O
- Cu + H2SO4 → CuSO4 + SO2 + H2O
………………………….
Trên đây TaiLieuViet đã giới thiệu SO2 + O2 + H2O → H2SO4 tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, TaiLieuViet xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà TaiLieuViet tổng hợp biên soạn và đăng tải.
Related posts
Tài liệu nổi bật
Categories
- Âm Nhạc – Mỹ Thuật Lớp 9 (17)
- Âm nhạc lớp 6 – KNTT (31)
- Âm Nhạc Lớp 7- CTST (23)
- Bài tập Toán 9 (8)
- Chưa phân loại (32)
- Chuyên đề Hóa học 12 (196)
- Chuyên đề Sinh học lớp 12 (61)
- Chuyên đề Toán 9 (50)
- Công Nghệ Lớp 10- CD (58)
- Công Nghệ Lớp 10- KNTT (52)
- Công nghệ Lớp 11 – KNTT (22)
- Công Nghệ Lớp 6 – CTST (15)
- Công Nghệ Lớp 6 – KNTT (16)
- Công Nghệ Lớp 7- CTST (18)
- Công Nghệ Lớp 7- KNTT (19)
- Công nghệ Lớp 8 – CD (21)
- Công nghệ Lớp 8 – CTST (18)
- Công nghệ Lớp 8 – KNTT (7)
- Công Nghệ Lớp 9 (114)
- Đề thi học kì 2 lớp 9 môn Văn (35)
- Địa Lí Lớp 10- CD (99)
- Địa Lí Lớp 10- KNTT (77)
- Địa lí Lớp 11 – CD (31)
- Địa lí Lớp 11 – CTST (23)
- Địa lí Lớp 11 – KNTT (19)
- Địa Lí Lớp 12 (134)
- Địa lí Lớp 6 – CTST (36)
- Địa lí Lớp 6 – KNTT (30)
- Địa Lí Lớp 7- CTST (22)
- Địa Lí Lớp 7- KNTT (19)
- Địa Lí Lớp 9 (290)
- GDCD 12 (28)
- GDCD Lớp 6 – CTST (8)
- GDCD Lớp 6 – KNTT (12)
- GDCD Lớp 9 (94)
- Giải bài tập Địa Lí 12 (12)
- Giải bài tập SGK Toán 12 (8)
- Giải bài tập Sinh học 12 (45)
- Giải SBT Hóa học 12 (71)
- Giải vở BT Văn 9 (122)
- Giáo Dục Công Dân Lớp 7- CTST (12)
- Giáo Dục Công Dân Lớp 7- KNTT (10)
- Giáo dục công dân Lớp 8 – CD (10)
- Giáo dục công dân Lớp 8 – CTST (10)
- Giáo dục công dân Lớp 8 – KNTT (10)
- Giáo Dục Quốc Phòng Lớp 10- CD (12)
- Giáo Dục Quốc Phòng Lớp 10- KNTT (12)
- Hóa Học Lớp 10- CD (30)
- Hóa Học Lớp 10- KNTT (61)
- Hoá Học Lớp 11 – CD (19)
- Hoá học Lớp 11 – CTST (19)
- Hoá học Lớp 11 – KNTT (25)
- Hóa Học Lớp 12 (130)
- Hóa Học Lớp 9 (717)
- Hoạt Động Trải Nghiệm Lớp 10- KNTT (52)
- Hoạt Động Trải Nghiệm Lớp 7- CTST (40)
- Hoạt Động Trải Nghiệm Lớp 7- KNTT (16)
- Hoạt động trải nghiệm Lớp 8 – CD (19)
- Hoạt động trải nghiệm Lớp 8 – CTST (9)
- Hoạt động trải nghiệm Lớp 8 – KNTT (18)
- Khoa học tự nhiên Lớp 6 – CTST (46)
- Khoa học tự nhiên Lớp 6 – KNTT (57)
- Khoa Học Tự Nhiên Lớp 7- CTST (51)
- Khoa học tự nhiên Lớp 8 – CD (51)
- Khoa học tự nhiên Lớp 8 – CTST (33)
- Khoa học tự nhiên Lớp 8 – KNTT (37)
- Kinh Tế & Pháp Luật Lớp 10 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CTST (11)
- Kinh tế & Pháp luật Lớp 11 – KNTT (11)
- Lịch Sử Lớp 10- CD (34)
- Lịch Sử Lớp 10- CTST (20)
- Lịch Sử Lớp 10- KNTT (42)
- Lịch sử Lớp 11 – CTST (13)
- Lịch sử Lớp 11 – KNTT (13)
- Lịch sử Lớp 6 – CTST (21)
- Lịch sử Lớp 6 – KNTT (22)
- Lịch Sử Lớp 7- CTST (19)
- Lịch sử lớp 7- KNTT (18)
- Lịch Sử Lớp 9 (148)
- Lịch sử và Địa lí Lớp 8 – CTST (40)
- Lịch sử và Địa lí Lớp 8 – KNTT (33)
- Lý thuyết Địa lý 12 (4)
- Lý thuyết Lịch sử lớp 9 (33)
- Lý thuyết Ngữ Văn (83)
- Lý thuyết Ngữ Văn 12 (18)
- Lý thuyết Sinh học 12 (41)
- Mở bài – Kết bài hay (55)
- Mở bài lớp 12 hay (24)
- Nghị luận xã hội (34)
- Ngữ Văn Lớp 10- CD (113)
- Ngữ Văn Lớp 10- CTST (79)
- Ngữ Văn Lớp 10- KNTT (198)
- Ngữ Văn Lớp 11 – CD (51)
- Ngữ văn Lớp 11 – CTST (89)
- Ngữ Văn Lớp 11 – KNTT (107)
- Ngữ Văn Lớp 12 (379)
- Ngữ Văn Lớp 6 – KNTT (293)
- Ngữ Văn Lớp 7- CTST (103)
- Ngữ Văn Lớp 7- KNTT (66)
- Ngữ văn Lớp 8 – CD (48)
- Ngữ văn Lớp 8 – CTST (123)
- Ngữ văn Lớp 8 – KNTT (196)
- Ngữ Văn Lớp 9 (28)
- Phân tích các tác phẩm lớp 12 (12)
- Sinh Học Lớp 10- CD (49)
- Sinh Học Lớp 10- CTST (61)
- Sinh Học Lớp 10- KNTT (71)
- Sinh Học Lớp 11 – CD (16)
- Sinh học Lớp 11 – CTST (18)
- Sinh học Lớp 11 – KNTT (18)
- Sinh Học Lớp 9 (229)
- Soạn Anh 12 mới (86)
- Soạn văn 9 (50)
- SOẠN VĂN 9 BÀI 1 (50)
- SOẠN VĂN 9 BÀI 2 (50)
- Tác giả – Tác phẩm (41)
- Tác giả – Tác phẩm Ngữ Văn 12 (13)
- Thi THPT QG môn Địa lý (12)
- Thi THPT QG môn Sinh (8)
- Tiếng Anh Lớp 10 Friends Global (57)
- Tiếng Anh Lớp 10 Global Success (604)
- Tiếng Anh Lớp 10 iLearn Smart World (98)
- Tiếng anh Lớp 11 Friends Global (171)
- Tiếng anh Lớp 11 Global Success (368)
- Tiếng anh Lớp 11 iLearn Smart World (104)
- Tiếng Anh Lớp 12 cũ (168)
- Tiếng Anh Lớp 6 Friends Plus (114)
- Tiếng Anh Lớp 6 Global Success (174)
- Tiếng Anh Lớp 7 Friends Plus (160)
- Tiếng Anh Lớp 8 Friends plus (71)
- Tiếng anh Lớp 8 Global Success (79)
- Tiếng anh Lớp 8 iLearn Smart World (40)
- Tiếng Anh Lớp 9 Mới (211)
- Tin Học Lớp 10- CD (24)
- Tin Học Lớp 10- KNTT (33)
- Tin học Lớp 11 – KNTT (21)
- Tin Học Lớp 6 – CTST (41)
- Tin Học Lớp 6- KNTT (17)
- Tin Học Lớp 7- CTST (14)
- Tin Học Lớp 7- KNTT (16)
- Tin học Lớp 8 – CD (36)
- Tin học Lớp 8 – CTST (10)
- Tin học Lớp 8 – KNTT (5)
- Tin Học Lớp 9 (21)
- Toán 10 sách Chân trời sáng tạo (42)
- Toán Lớp 1 – KNTT (1)
- Toán Lớp 10- CD (44)
- Toán Lớp 10- CTST (39)
- Toán Lớp 10- KNTT (161)
- Toán Lớp 11 – CD (19)
- Toán Lớp 11 – CTST (44)
- Toán Lớp 11 – KNTT (46)
- Toán Lớp 12 (123)
- Toán Lớp 6 – CTST (62)
- Toán Lớp 6 – KNTT (102)
- Toán Lớp 7- CTST (52)
- Toán Lớp 7- KNTT (74)
- Toán Lớp 8 – CD (23)
- Toán Lớp 8 – CTST (21)
- Toán Lớp 8 – KNTT (34)
- Toán Lớp 9 (194)
- Tóm tắt Ngữ văn (16)
- Trắc nghiệm Ngữ Văn (75)
- Trắc nghiệm Toán 9 (61)
- Trải nghiệm hướng nghiệp Lớp 11 – KNTT (8)
- Văn mẫu 12 phân tích chuyên sâu (12)
- Văn mẫu 9 (273)
- Vật Lí Lớp 10- CD (39)
- Vật Lí Lớp 10- KNTT (61)
- Vật Lí Lớp 11 – CD (18)
- Vật lí Lớp 11 – CTST (20)
- Vật lí Lớp 11 – KNTT (26)
- Vật Lý Lớp 9 (217)