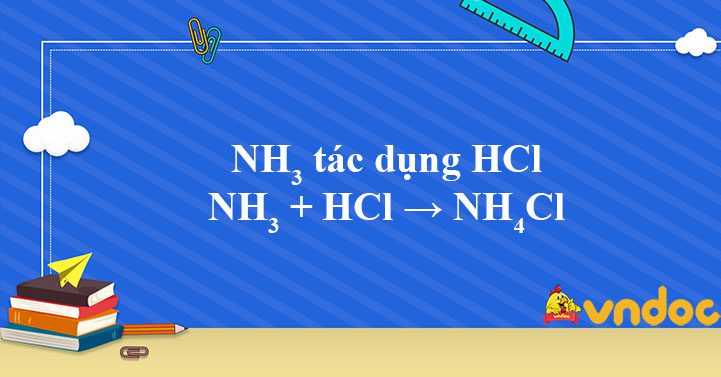
NH3 + HCl → NH4Cl là phương trình phản ứng hóa học giữa NH3 và dung dịch axit HCl đặc thấy khói trắng xuất hiện, do HCl và NH3 là những hợp chất dễ bay hơi nên chúng đã hóa hợp với nhau tạo thành tinh thể muối NH4Cl.
>> Mời các bạn tham khảo một số nội dung câu hỏi liên quan:
- Muối amoni là chất điện li thuộc loại
- Thành phần của dung dịch NH3 gồm
- Một lít nước ở 20 độ C hòa tan được bao nhiêu lít khí amoniac
- Cho vài giọt phenolphtalein vào dung dịch NH3 thì dung dịch chuyển thành
- Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
Mục Lục
Toggle1. Phương trình phản ứng NH3 tác dụng HCl đặc
2. Điều kiện phản ứng NH3 tác dụng HCl đặc
Nhiệt độ thường
3. NH3 tác dụng HCl đặc có hiện tượng
Khi đặt hai bình mở nút đựng dung dịch HCl đặc và dung dịch NH3 ở gần nhau thì thấy có “khói” màu trắng.
Do HCl và NH3 là những hợp chất dễ bay hơi nên chúng đã hóa hợp với nhau tạo thành tinh thể muối amoni clorua, chính tinh thể này đã tạo nên hiện tượng “khói”.
4. Tính chất hóa học của NH3
4.1. Amoniac có tính bazơ yếu
Amoniac do tính bazơ nên dung dịch amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng.
a) Amoniac phản ứng với nước
NH3 + H2O ⇔ NH4+ + OH–
b) Amoniac phản ứng với Axit → Muối Amoni
Thí dụ:
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
c) Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối
NH3 + Muối (dung dịch) → Bazơ + Muối mới
Thí dụ
2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
* Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan
Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
Thí dụ:
ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4
4.2. Amoniac có tính khử mạnh
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
a) Amoniac tác dụng với O2
4NH3 + 3O2 ![]() 2N2↑ + 6H2O
2N2↑ + 6H2O
4NH3 + 5O2 ![]() 4NO↑ + 6H2O
4NO↑ + 6H2O
b) Amoniac tác dụng với Cl2
3CuO + 2NH3![]() Cu + 3H2O + N2↑
Cu + 3H2O + N2↑
4.3. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
5. Bài tập vận dụng liên quan
Câu 1. Thực hiện thí nghiệm cho dung dịch NH3 vào dung dịch HCl đặc sau phản ứng có hiện tượng
A. Thu được dung dịch trong suốt
B. Xuất hiện kết tủa trắng
C. Xuất hiện khói trắng
D. Xuất hiện khí có mùi khai
Thực hiện thí nghiệm cho dung dịch NH3 vào dung dịch HCl đặc sau phản ứng có hiện tượng Xuất hiện khói trắng
Phương trình phản ứng minh họa
NH3 + HCl → NH4Cl
Câu 2. Khi dẫn khí NH3 vào bình chứa dung dịch HCl đặc thì phản ứng tạo ra khói trắng. Hợp chất tạo thành có công thức là?
A. N2
B. NH3
C. NH4Cl
D. HCl
Khi dẫn khí NH3 vào bình chứa dung dịch HCl đặc thì phản ứng tạo ra khói trắng. Hợp chất tạo thành có công thức là NH4Cl
Phương trình phản ứng minh họa
NH3 + HCl → NH4Cl
Câu 3. Nhận xét nào sau đây nói về muối amoni là đúng:
A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion hiđroxit
B. Tất cả các muối amoni đều tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng được với dung dịch kiềm đặc, nóng thoát ra chất khí làm quỳ tím hóa đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
A sai vì muối amoni là tinh thể ion, phân tử gồm cation amoni và anion gốc axit
C sai vì khí làm quì hóa xanh
D sai vì khi nhiệt phân muối amoni chưa chắc ra khi amoniac.
Phương trình ví dụ minh họa: NH4NO2 → N2 + 2H2O
Câu 4. Khi dẫn khí NH3 vào bình chứa Cl2 thì phản ứng tạo ra khói trắng. Hợp chất tạo thành có công thức là?
A. N2
B. NH3
C. NH4Cl
D. HCl
Phương trình phản ứng minh họa
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HClkhí → NH4Cl(khói trắng)
Câu 5. Cho 11,2 lít hỗn hợp khi X gồm N2 và H2 đi qua xúc tác Fe, nung nống để tổng hợp NH3 thu được 10,08 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch AlCl3 dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
A. 1,3.
B. 2,6.
C. 5,2.
D. 3,9.
nX = 0,5 mol; nNH3 = nX – nY = 0,5 – 0,45 = 0,05 mol
⇒ nAl(OH)3 = 0,05 /3 ⇒ m = 1,3 g
Câu 6. Nhận định nào sau đây đúng về NH3
(a) Amoni tan tốt trong nước
(b) Là chất khí không màu, không mùi, không vị
(c) Là chất khí không màu, có mùi khai
(d) Amoni có tính bazơ yếu
(e) Amoni là chất khí nhẹ hơn không khí
A. (a); (c); (d); (e)
B. (a); (b); (d); (e)
C. (a); (b); (c); (e)
D. (b); (c); (d); (e)
Nhận định đúng về NH3
(a) Amoni tan tốt trong nước
(c) Là chất khí không màu, có mùi khai
(d) Amoni có tính bazơ yếu
(e) Amoni là chất khí nhẹ hơn không khí
Câu 7. Trong các phát biểu dưới đây, chỉ ra phát biểu chưa đúng
A. Các muối amoni đều dễ tan trong nước
B. Các muối amoni khi tan đều điện li hoàn toàn thành ion
C. Các muối amoni khi đun nóng đều bị phân hủy thành amoniac và Axit
D. Có thể dùng muối amoni để đều chế NH3 trong phòng thí nghiệm
Câu 8. Axit nitric tinh khiết là chất lỏng không màu nhưng khi chúng ta vào trong phòng thí nghiệm lại quan sát thấy lọ Axit nitric đặc có màu nâu vàng hoặc nâu là do.
A. Axit nitric oxi hóa bụi bẩn trong không khí tạo hợp chất có màu
B. Axit nitric tự oxi hóa thành hợp chất có màu
C. Axit nitric bị phân hủy 1 ít tạo NO2 tan lại trong HNO3 lỏng
D. Axit nitric hút nước mạnh tạo dung dịch có màu.
Axit nitric tinh khiết là chất lỏng không màu nhưng khi chúng ta vào trong phòng thí nghiệm lại quan sát thấy lọ Axit nitric đặccó màu nâu vàng hoặc nâu là do Axit nitric hút nước mạnh tạo dung dịch có màu.
Câu 9. Hòa tan 25,6 gam bột Cu trong 400 ml dung dịch hỗn hợp KNO3 0,5M và H2SO4 1M. Thể tích khí NO (sản phẩm khử duy nhất) thoát ra ở đktc là
A. 2,24 lít.
B. 2,99 lít.
C. 4,48 lít.
D. 11,2 lít.
Câu 10. Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ mol 1: 3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là
A. 65%.
B. 60%.
C. 80%.
D. 70%.
Phương trình phản ứng:
N2 + 3H2 ⇔ 2NH3
Ban đầu: 1 mol 3 mol
Phản ứng: a → 3a → 2a
Dư: 1 – a 3 – 3a 2a
=> nhỗn hợp sau phản ứng = 1 – a + 3 – 3a + 2a = 4 – 2a
nhỗn hợp trước phản ứng = 1 + 3 = 4 mol
Bảo toàn khối lượng: mtrước = msau => Mt.nt = Ms.ns
=>Mt/Ms = ns/nt => (4−2a)/4 = 0,6 => a = 0,8
=> H = 0,8/1.100% = 80%
Câu 11. Cho các mệnh đề sau:
1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
2) Ion NO3– có tính oxi hóa trong môi trường axit.
3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2.
4) Hầu hết muối nitrat đều bền nhiệt.
Các mệnh đề đúng là:
A. (1), (2), (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 12. Phân biệt ba dung dịch axit NaCl; NaNO3 và Na3PO4 bằng :
A. Quỳ tím
B. NaOH
C. Ba(OH)2
D. AgNO3
Phân biệt ba dung dịch axit NaCl; NaNO3 và Na3PO4 bằng AgNO3
+ NaCl tạo kết tủa trắng
+ Na3PO4 tạo kết tủa vàng
+ NaNO3 không hiện tượng
……………………………………………….
>>
- NH3 + HNO3 → NH4NO3
- NH3 + Cl2 → N2 + NH4Cl
- NH3 + O2 → NO + H2O
- NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
- NH4Cl + AgNO3 → NH4NO3 + AgCl
- NH4Cl + NaOH → NH3 + H2O + NaCl
- NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O
Trên đây TaiLieuViet.vn vừa giới thiệu tới các bạn bài viết NH3 + HCl → NH4Cl, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11…
Related posts
Tài liệu nổi bật
Categories
- Âm Nhạc – Mỹ Thuật Lớp 9 (17)
- Âm nhạc lớp 6 – KNTT (31)
- Âm Nhạc Lớp 7- CTST (23)
- Bài tập Toán 9 (8)
- Chưa phân loại (32)
- Chuyên đề Hóa học 12 (196)
- Chuyên đề Sinh học lớp 12 (61)
- Chuyên đề Toán 9 (50)
- Công Nghệ Lớp 10- CD (58)
- Công Nghệ Lớp 10- KNTT (52)
- Công nghệ Lớp 11 – KNTT (22)
- Công Nghệ Lớp 6 – CTST (15)
- Công Nghệ Lớp 6 – KNTT (16)
- Công Nghệ Lớp 7- CTST (18)
- Công Nghệ Lớp 7- KNTT (19)
- Công nghệ Lớp 8 – CD (21)
- Công nghệ Lớp 8 – CTST (18)
- Công nghệ Lớp 8 – KNTT (7)
- Công Nghệ Lớp 9 (114)
- Đề thi học kì 2 lớp 9 môn Văn (35)
- Địa Lí Lớp 10- CD (99)
- Địa Lí Lớp 10- KNTT (77)
- Địa lí Lớp 11 – CD (31)
- Địa lí Lớp 11 – CTST (23)
- Địa lí Lớp 11 – KNTT (19)
- Địa Lí Lớp 12 (134)
- Địa lí Lớp 6 – CTST (36)
- Địa lí Lớp 6 – KNTT (30)
- Địa Lí Lớp 7- CTST (22)
- Địa Lí Lớp 7- KNTT (19)
- Địa Lí Lớp 9 (290)
- GDCD 12 (28)
- GDCD Lớp 6 – CTST (8)
- GDCD Lớp 6 – KNTT (12)
- GDCD Lớp 9 (94)
- Giải bài tập Địa Lí 12 (12)
- Giải bài tập SGK Toán 12 (8)
- Giải bài tập Sinh học 12 (45)
- Giải SBT Hóa học 12 (71)
- Giải vở BT Văn 9 (122)
- Giáo Dục Công Dân Lớp 7- CTST (12)
- Giáo Dục Công Dân Lớp 7- KNTT (10)
- Giáo dục công dân Lớp 8 – CD (10)
- Giáo dục công dân Lớp 8 – CTST (10)
- Giáo dục công dân Lớp 8 – KNTT (10)
- Giáo Dục Quốc Phòng Lớp 10- CD (12)
- Giáo Dục Quốc Phòng Lớp 10- KNTT (12)
- Hóa Học Lớp 10- CD (30)
- Hóa Học Lớp 10- KNTT (61)
- Hoá Học Lớp 11 – CD (19)
- Hoá học Lớp 11 – CTST (19)
- Hoá học Lớp 11 – KNTT (25)
- Hóa Học Lớp 12 (130)
- Hóa Học Lớp 9 (717)
- Hoạt Động Trải Nghiệm Lớp 10- KNTT (52)
- Hoạt Động Trải Nghiệm Lớp 7- CTST (40)
- Hoạt Động Trải Nghiệm Lớp 7- KNTT (16)
- Hoạt động trải nghiệm Lớp 8 – CD (19)
- Hoạt động trải nghiệm Lớp 8 – CTST (9)
- Hoạt động trải nghiệm Lớp 8 – KNTT (18)
- Khoa học tự nhiên Lớp 6 – CTST (46)
- Khoa học tự nhiên Lớp 6 – KNTT (57)
- Khoa Học Tự Nhiên Lớp 7- CTST (51)
- Khoa học tự nhiên Lớp 8 – CD (51)
- Khoa học tự nhiên Lớp 8 – CTST (33)
- Khoa học tự nhiên Lớp 8 – KNTT (37)
- Kinh Tế & Pháp Luật Lớp 10 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CTST (11)
- Kinh tế & Pháp luật Lớp 11 – KNTT (11)
- Lịch Sử Lớp 10- CD (34)
- Lịch Sử Lớp 10- CTST (20)
- Lịch Sử Lớp 10- KNTT (42)
- Lịch sử Lớp 11 – CTST (13)
- Lịch sử Lớp 11 – KNTT (13)
- Lịch sử Lớp 6 – CTST (21)
- Lịch sử Lớp 6 – KNTT (22)
- Lịch Sử Lớp 7- CTST (19)
- Lịch sử lớp 7- KNTT (18)
- Lịch Sử Lớp 9 (148)
- Lịch sử và Địa lí Lớp 8 – CTST (40)
- Lịch sử và Địa lí Lớp 8 – KNTT (33)
- Lý thuyết Địa lý 12 (4)
- Lý thuyết Lịch sử lớp 9 (33)
- Lý thuyết Ngữ Văn (83)
- Lý thuyết Ngữ Văn 12 (18)
- Lý thuyết Sinh học 12 (41)
- Mở bài – Kết bài hay (55)
- Mở bài lớp 12 hay (24)
- Nghị luận xã hội (34)
- Ngữ Văn Lớp 10- CD (113)
- Ngữ Văn Lớp 10- CTST (79)
- Ngữ Văn Lớp 10- KNTT (198)
- Ngữ Văn Lớp 11 – CD (51)
- Ngữ văn Lớp 11 – CTST (89)
- Ngữ Văn Lớp 11 – KNTT (107)
- Ngữ Văn Lớp 12 (379)
- Ngữ Văn Lớp 6 – KNTT (293)
- Ngữ Văn Lớp 7- CTST (103)
- Ngữ Văn Lớp 7- KNTT (66)
- Ngữ văn Lớp 8 – CD (48)
- Ngữ văn Lớp 8 – CTST (123)
- Ngữ văn Lớp 8 – KNTT (196)
- Ngữ Văn Lớp 9 (28)
- Phân tích các tác phẩm lớp 12 (12)
- Sinh Học Lớp 10- CD (49)
- Sinh Học Lớp 10- CTST (61)
- Sinh Học Lớp 10- KNTT (71)
- Sinh Học Lớp 11 – CD (16)
- Sinh học Lớp 11 – CTST (18)
- Sinh học Lớp 11 – KNTT (18)
- Sinh Học Lớp 9 (229)
- Soạn Anh 12 mới (86)
- Soạn văn 9 (50)
- SOẠN VĂN 9 BÀI 1 (50)
- SOẠN VĂN 9 BÀI 2 (50)
- Tác giả – Tác phẩm (41)
- Tác giả – Tác phẩm Ngữ Văn 12 (13)
- Thi THPT QG môn Địa lý (12)
- Thi THPT QG môn Sinh (8)
- Tiếng Anh Lớp 10 Friends Global (57)
- Tiếng Anh Lớp 10 Global Success (604)
- Tiếng Anh Lớp 10 iLearn Smart World (98)
- Tiếng anh Lớp 11 Friends Global (171)
- Tiếng anh Lớp 11 Global Success (368)
- Tiếng anh Lớp 11 iLearn Smart World (104)
- Tiếng Anh Lớp 12 cũ (168)
- Tiếng Anh Lớp 6 Friends Plus (114)
- Tiếng Anh Lớp 6 Global Success (174)
- Tiếng Anh Lớp 7 Friends Plus (160)
- Tiếng Anh Lớp 8 Friends plus (71)
- Tiếng anh Lớp 8 Global Success (79)
- Tiếng anh Lớp 8 iLearn Smart World (40)
- Tiếng Anh Lớp 9 Mới (211)
- Tin Học Lớp 10- CD (24)
- Tin Học Lớp 10- KNTT (33)
- Tin học Lớp 11 – KNTT (21)
- Tin Học Lớp 6 – CTST (41)
- Tin Học Lớp 6- KNTT (17)
- Tin Học Lớp 7- CTST (14)
- Tin Học Lớp 7- KNTT (16)
- Tin học Lớp 8 – CD (36)
- Tin học Lớp 8 – CTST (10)
- Tin học Lớp 8 – KNTT (5)
- Tin Học Lớp 9 (21)
- Toán 10 sách Chân trời sáng tạo (42)
- Toán Lớp 1 – KNTT (1)
- Toán Lớp 10- CD (44)
- Toán Lớp 10- CTST (39)
- Toán Lớp 10- KNTT (161)
- Toán Lớp 11 – CD (19)
- Toán Lớp 11 – CTST (44)
- Toán Lớp 11 – KNTT (46)
- Toán Lớp 12 (123)
- Toán Lớp 6 – CTST (62)
- Toán Lớp 6 – KNTT (102)
- Toán Lớp 7- CTST (52)
- Toán Lớp 7- KNTT (74)
- Toán Lớp 8 – CD (23)
- Toán Lớp 8 – CTST (21)
- Toán Lớp 8 – KNTT (34)
- Toán Lớp 9 (194)
- Tóm tắt Ngữ văn (16)
- Trắc nghiệm Ngữ Văn (75)
- Trắc nghiệm Toán 9 (61)
- Trải nghiệm hướng nghiệp Lớp 11 – KNTT (8)
- Văn mẫu 12 phân tích chuyên sâu (12)
- Văn mẫu 9 (273)
- Vật Lí Lớp 10- CD (39)
- Vật Lí Lớp 10- KNTT (61)
- Vật Lí Lớp 11 – CD (18)
- Vật lí Lớp 11 – CTST (20)
- Vật lí Lớp 11 – KNTT (26)
- Vật Lý Lớp 9 (217)