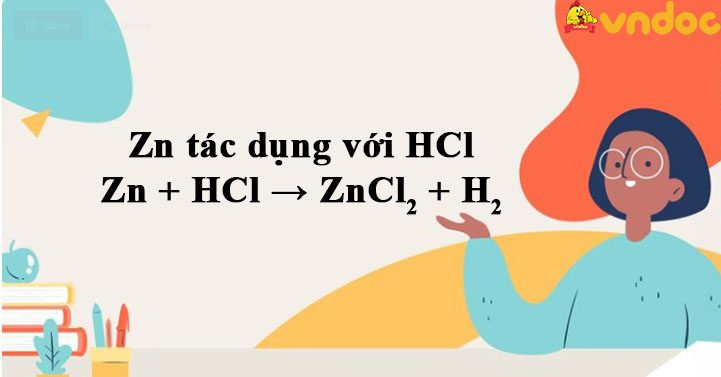
Zn + HCl → ZnCl2 + H2 được TaiLieuViet biên soạn hướng dẫn các bạn học sinh viết trình điều chế khí hidro trong phòng thí nghiệm. Mời các bạn tham khảo chi tiết nội dung phương trình Zn tác dụng với HCl.
Mục Lục
Toggle1. Phương trình phản ứng Zn tác dụng HCl
Đây cũng là một trong các phương trình điều chế khí hiđro phản ứng thế
2. Điều kiện để phản ứng Zn tác dụng HCl
Nhiệt độ
3. Điều chế H2 trong phòng thí nghiệm
Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách:
Đẩy nước và đẩy không khí.
4. Tính chất hóa học của hidro
Hidro tác dụng với oxi
Phương trình hóa học:
2H2 + O2 → 2H2O
Lưu ý rằng khi hỗn hợp khí oxi và khí hidro sẽ gây nổ. Nếu như chúng ta trộn hai khí này theo tỉ lệ 2:1 thể tích Khí hiđro và khí oxi thì hỗn hợp sẽ tạo nổ mạnh nhất.
Nguyên nhân tạo ra hiện tượng này bao nhiêu đó chính là hỗn hợp cháy rất nhanh và tỏa nhiều nhiệt.
Nhiệt này sẽ làm cho thể tích của hơi nước tạo nên sau khi phản ứng tăng cao đột ngột rất nhiều lần. Vì vậy sẽ làm chấn động mạnh đến không khí và gây nổ.
Hidro tác dụng với đồng oxit
Khi cho khí hidro đi qua bột đồng II thì oxit CuO sẽ chuyển thành màu đen.
Khi ống đựng bột CuO được đun nóng ở dưới ngọn lửa của đèn cồn. Sau đó sẽ cho khí H2 đi qua thì ta sẽ nhìn thấy có xuất hiện một chất rắn màu đỏ gạch và sẽ có nước đọng ở trên thành của ống nghiệm.
- Hidro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C
H2 + CuO → Cu+ H2O
Trong phản ứng hóa học trên, hidro đã chiếm chỗ của oxi trong CuO. Ta nói hidro có tính khử.
5. Bài tập vận dụng liên quan
Câu 1. Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Câu 2. Sau phản ứng của CuO và H2 thì có hiện tượng gì:
D. Không có hiện tượng
Câu 3. Điều chế Hidro trong công nghiệp, người ta dùng:
A. Cho Zn + HCl
B. Fe + H2SO4
C. Điện phân nước
D. Khí dầu hỏa
Câu 4. Sau phản ứng Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí , khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Đỏ
B. Xanh nhạt
C. Cam
D. Tím
Câu 5. Cho 6,5g Zn phản ứng với axit clohidric thấy có khí bay lên với thể tích là
A. 22,4 (l)
B. 0,224 (l)
C. 2,24 (l)
D. 4,8 (l)
Câu 6. Các phản ứng cho dưới đây, phản ứng nào là phản ứng oxi hoá- khử?
A. CO2 + NaOH → NaHCO3
B. CO2 + H2O → H2CO3
C. CO2 + 2Mg → 2MgO + C
D. CO2 + Ca(OH)2 → CaCO3 + H2O
Câu 7. Cho các phản ứng sau, phản ứng nào không phải phản ứng thế
A. Fe + 2HCl → FeCl2 + H2
B. Fe + CuSO4 → FeSO4 + Cu
C. H2SO4 + BaCl2 → BaSO4 + HCl
D. Al + CuO → Cu + Al2O3
Câu 8. Dung dịch A chứa 0,4 mol HCl, dung dịch B chứa 0,2 mol KHCO3 và 0,3 mol K2CO3. Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra x mol khí . Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra y mol khí. Giá trị của x và y lần lượt là
A. 0,10 và 0,50
B. 0,30 và 0,20
C. 0,20 và 0,30
D. 0,10 và 0,25
Nếu cho từ từ HCl (X) vào dung dịch Y, phản ứng 1 và 2 sau đây sẽ xảy ra lần lượt:
HCl + K2CO3 → KHCO3 + KCl (1)
HCl + KHCO3 → KCl + H2O + CO2 (2)
Phản ứng 1: nK2CO3 = nHCl p/u (1) = 0,3 mol
Phản ứng 2: nCO2 = nHCl p/u (2) = 0,4 – 0,3 = 0,1 mol
Nếu cho từ từ Y vào dung dịch HCl (X): phản ứng 3 và 4 sau đây sẽ xảy ra đồng thời:
2HCl + K2CO3 → KCl + H2O + CO2 (3)
HCl + KHCO3 → KCl + H2O + CO2 (4)
Tỉ lệ số mol phản ứng là: nKHCO3 : nK2CO3 = 2 : 3
Đặt số mol KHCO3 phản ứng là x thì số mol K2CO3 phản ứng là 1,5x
Phản ứng 3: nHCl p/u (3) = 2nCO2= 3x
Phản ứng 4: nHCl p/u (4) = nKHCO3 = x
Ta có: nHCl = 4x = 0,4 mol .
Vậy x = 0,1 mol
nCO2 = 1,5x + x. Vậy nCO2 = 0,25 mol
…………………………………
Trên đây TaiLieuViet đã giới thiệu Zn + HCl → ZnCl2 + H2. Để có kết quả học tập tốt và hiệu quả hơn, TaiLieuViet xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà TaiLieuViet tổng hợp biên soạn và đăng tải.
Related posts
Tài liệu nổi bật
Categories
- Âm Nhạc – Mỹ Thuật Lớp 9 (17)
- Âm nhạc lớp 6 – KNTT (31)
- Âm Nhạc Lớp 7- CTST (23)
- Bài tập Toán 9 (8)
- Chưa phân loại (32)
- Chuyên đề Hóa học 12 (196)
- Chuyên đề Sinh học lớp 12 (61)
- Chuyên đề Toán 9 (50)
- Công Nghệ Lớp 10- CD (58)
- Công Nghệ Lớp 10- KNTT (52)
- Công nghệ Lớp 11 – KNTT (22)
- Công Nghệ Lớp 6 – CTST (15)
- Công Nghệ Lớp 6 – KNTT (16)
- Công Nghệ Lớp 7- CTST (18)
- Công Nghệ Lớp 7- KNTT (19)
- Công nghệ Lớp 8 – CD (21)
- Công nghệ Lớp 8 – CTST (18)
- Công nghệ Lớp 8 – KNTT (7)
- Công Nghệ Lớp 9 (114)
- Đề thi học kì 2 lớp 9 môn Văn (35)
- Địa Lí Lớp 10- CD (99)
- Địa Lí Lớp 10- KNTT (77)
- Địa lí Lớp 11 – CD (31)
- Địa lí Lớp 11 – CTST (23)
- Địa lí Lớp 11 – KNTT (19)
- Địa Lí Lớp 12 (134)
- Địa lí Lớp 6 – CTST (36)
- Địa lí Lớp 6 – KNTT (30)
- Địa Lí Lớp 7- CTST (22)
- Địa Lí Lớp 7- KNTT (19)
- Địa Lí Lớp 9 (290)
- GDCD 12 (28)
- GDCD Lớp 6 – CTST (8)
- GDCD Lớp 6 – KNTT (12)
- GDCD Lớp 9 (94)
- Giải bài tập Địa Lí 12 (12)
- Giải bài tập SGK Toán 12 (8)
- Giải bài tập Sinh học 12 (45)
- Giải SBT Hóa học 12 (71)
- Giải vở BT Văn 9 (122)
- Giáo Dục Công Dân Lớp 7- CTST (12)
- Giáo Dục Công Dân Lớp 7- KNTT (10)
- Giáo dục công dân Lớp 8 – CD (10)
- Giáo dục công dân Lớp 8 – CTST (10)
- Giáo dục công dân Lớp 8 – KNTT (10)
- Giáo Dục Quốc Phòng Lớp 10- CD (12)
- Giáo Dục Quốc Phòng Lớp 10- KNTT (12)
- Hóa Học Lớp 10- CD (30)
- Hóa Học Lớp 10- KNTT (61)
- Hoá Học Lớp 11 – CD (19)
- Hoá học Lớp 11 – CTST (19)
- Hoá học Lớp 11 – KNTT (25)
- Hóa Học Lớp 12 (130)
- Hóa Học Lớp 9 (717)
- Hoạt Động Trải Nghiệm Lớp 10- KNTT (52)
- Hoạt Động Trải Nghiệm Lớp 7- CTST (40)
- Hoạt Động Trải Nghiệm Lớp 7- KNTT (16)
- Hoạt động trải nghiệm Lớp 8 – CD (19)
- Hoạt động trải nghiệm Lớp 8 – CTST (9)
- Hoạt động trải nghiệm Lớp 8 – KNTT (18)
- Khoa học tự nhiên Lớp 6 – CTST (46)
- Khoa học tự nhiên Lớp 6 – KNTT (57)
- Khoa Học Tự Nhiên Lớp 7- CTST (51)
- Khoa học tự nhiên Lớp 8 – CD (51)
- Khoa học tự nhiên Lớp 8 – CTST (33)
- Khoa học tự nhiên Lớp 8 – KNTT (37)
- Kinh Tế & Pháp Luật Lớp 10 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CTST (11)
- Kinh tế & Pháp luật Lớp 11 – KNTT (11)
- Lịch Sử Lớp 10- CD (34)
- Lịch Sử Lớp 10- CTST (20)
- Lịch Sử Lớp 10- KNTT (42)
- Lịch sử Lớp 11 – CTST (13)
- Lịch sử Lớp 11 – KNTT (13)
- Lịch sử Lớp 6 – CTST (21)
- Lịch sử Lớp 6 – KNTT (22)
- Lịch Sử Lớp 7- CTST (19)
- Lịch sử lớp 7- KNTT (18)
- Lịch Sử Lớp 9 (148)
- Lịch sử và Địa lí Lớp 8 – CTST (40)
- Lịch sử và Địa lí Lớp 8 – KNTT (33)
- Lý thuyết Địa lý 12 (4)
- Lý thuyết Lịch sử lớp 9 (33)
- Lý thuyết Ngữ Văn (83)
- Lý thuyết Ngữ Văn 12 (18)
- Lý thuyết Sinh học 12 (41)
- Mở bài – Kết bài hay (55)
- Mở bài lớp 12 hay (24)
- Nghị luận xã hội (34)
- Ngữ Văn Lớp 10- CD (113)
- Ngữ Văn Lớp 10- CTST (79)
- Ngữ Văn Lớp 10- KNTT (198)
- Ngữ Văn Lớp 11 – CD (51)
- Ngữ văn Lớp 11 – CTST (89)
- Ngữ Văn Lớp 11 – KNTT (107)
- Ngữ Văn Lớp 12 (379)
- Ngữ Văn Lớp 6 – KNTT (293)
- Ngữ Văn Lớp 7- CTST (103)
- Ngữ Văn Lớp 7- KNTT (66)
- Ngữ văn Lớp 8 – CD (48)
- Ngữ văn Lớp 8 – CTST (123)
- Ngữ văn Lớp 8 – KNTT (196)
- Ngữ Văn Lớp 9 (28)
- Phân tích các tác phẩm lớp 12 (12)
- Sinh Học Lớp 10- CD (49)
- Sinh Học Lớp 10- CTST (61)
- Sinh Học Lớp 10- KNTT (71)
- Sinh Học Lớp 11 – CD (16)
- Sinh học Lớp 11 – CTST (18)
- Sinh học Lớp 11 – KNTT (18)
- Sinh Học Lớp 9 (229)
- Soạn Anh 12 mới (86)
- Soạn văn 9 (50)
- SOẠN VĂN 9 BÀI 1 (50)
- SOẠN VĂN 9 BÀI 2 (50)
- Tác giả – Tác phẩm (41)
- Tác giả – Tác phẩm Ngữ Văn 12 (13)
- Thi THPT QG môn Địa lý (12)
- Thi THPT QG môn Sinh (8)
- Tiếng Anh Lớp 10 Friends Global (57)
- Tiếng Anh Lớp 10 Global Success (604)
- Tiếng Anh Lớp 10 iLearn Smart World (98)
- Tiếng anh Lớp 11 Friends Global (171)
- Tiếng anh Lớp 11 Global Success (368)
- Tiếng anh Lớp 11 iLearn Smart World (104)
- Tiếng Anh Lớp 12 cũ (168)
- Tiếng Anh Lớp 6 Friends Plus (114)
- Tiếng Anh Lớp 6 Global Success (174)
- Tiếng Anh Lớp 7 Friends Plus (160)
- Tiếng Anh Lớp 8 Friends plus (71)
- Tiếng anh Lớp 8 Global Success (79)
- Tiếng anh Lớp 8 iLearn Smart World (40)
- Tiếng Anh Lớp 9 Mới (211)
- Tin Học Lớp 10- CD (24)
- Tin Học Lớp 10- KNTT (33)
- Tin học Lớp 11 – KNTT (21)
- Tin Học Lớp 6 – CTST (41)
- Tin Học Lớp 6- KNTT (17)
- Tin Học Lớp 7- CTST (14)
- Tin Học Lớp 7- KNTT (16)
- Tin học Lớp 8 – CD (36)
- Tin học Lớp 8 – CTST (10)
- Tin học Lớp 8 – KNTT (5)
- Tin Học Lớp 9 (21)
- Toán 10 sách Chân trời sáng tạo (42)
- Toán Lớp 1 – KNTT (1)
- Toán Lớp 10- CD (44)
- Toán Lớp 10- CTST (39)
- Toán Lớp 10- KNTT (161)
- Toán Lớp 11 – CD (19)
- Toán Lớp 11 – CTST (44)
- Toán Lớp 11 – KNTT (46)
- Toán Lớp 12 (123)
- Toán Lớp 6 – CTST (62)
- Toán Lớp 6 – KNTT (102)
- Toán Lớp 7- CTST (52)
- Toán Lớp 7- KNTT (74)
- Toán Lớp 8 – CD (23)
- Toán Lớp 8 – CTST (21)
- Toán Lớp 8 – KNTT (34)
- Toán Lớp 9 (194)
- Tóm tắt Ngữ văn (16)
- Trắc nghiệm Ngữ Văn (75)
- Trắc nghiệm Toán 9 (61)
- Trải nghiệm hướng nghiệp Lớp 11 – KNTT (8)
- Văn mẫu 12 phân tích chuyên sâu (12)
- Văn mẫu 9 (273)
- Vật Lí Lớp 10- CD (39)
- Vật Lí Lớp 10- KNTT (61)
- Vật Lí Lớp 11 – CD (18)
- Vật lí Lớp 11 – CTST (20)
- Vật lí Lớp 11 – KNTT (26)
- Vật Lý Lớp 9 (217)