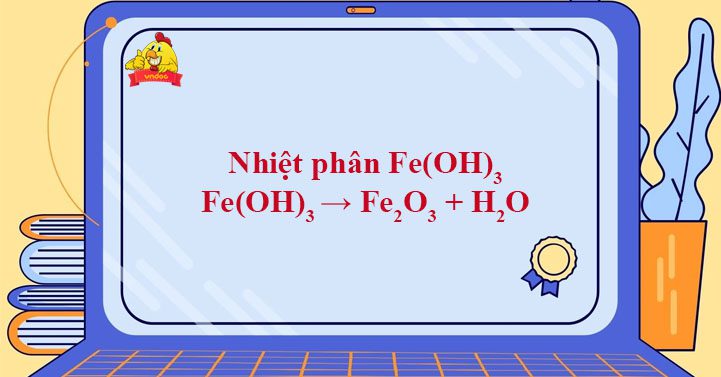
Fe(OH)3 → Fe2O3 + H2O được TaiLieuViet biên soạn giúp bạn đọc viết và cân bằng chính xác phản ứng nhiệt phân Fe(OH)3, từ đó vận dụng giải các bài tập nhiệt phân cũng như hoàn thành các chuỗi phản ứng hóa học vô cơ từ Fe(OH)3 ra Fe2O3 dựa vào phương trình này.
>> Một số nội dung câu hỏi liên quan:
- Fe(OH)3 kết tủa màu gì?
- Hiện tượng xảy ra khi đốt sắt trong bình khí Clo là
- Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng có hiện tượng sau
- Cho sắt phản ứng với dung dịch HNO3 đặc nóng thu được một chất khí màu nâu đỏ chất khí đó là
Mục Lục
Toggle1. Phương trình nhiệt phân Fe(OH)3
2. Điều kiện để phản ứng Fe(OH)3 ra Fe2O3
Nhiệ độ
3. Bazơ không tan bị nhiệt phân huỷ tạo thành oxit và nước
Tương tự Fe(OH)3, một số bazơ không tan khác như Cu(OH)2, Al(OH)3,… cũng bị nhiệt phân huỷ tạo ra oxit và nước.
Cu(OH)2![]() CuO + H2O
CuO + H2O
4. Tính chất hóa học của Fe(OH)3
Tính chất của Sắt hidroxit Fe(OH)3
Là một hidroxit tạo bởi Fe3+ và nhóm OH. Tồn tại ở trạng thái rắn, có màu nâu đỏ.
Công thức phân tử: Fe(OH)3
Tính chất vật lí: Là chất rắn, màu nâu đỏ, không tan trong nước.
4.1. Fe(OH)3 Bị nhiệt phân
2Fe(OH)3![]() Fe2O3 + 3H2O
Fe2O3 + 3H2O
4. 2. Tác dụng với axit
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
4.3. Điều chế Fe(OH)3
Cho dung dịch bazơ vào dung dịch muối sắt (III).
Fe3+ + 3OH- → Fe(OH)3
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 ↓ + 3BaCl2
5. Bài tập vận dụng liên quan
Câu 1. Bazo nào dưới đây bị nhiệt phân hủy tạo thành oxit và nước
A. Ba(OH)2.
B. Ca(OH)2.
C. KOH.
D. Zn(OH)2.
Ba(OH)2, Ca(OH)2, KOH đều là baso tan không bị nhiệt phân hủy
Phương trình phản ứng xảy ra
Zn(OH)2 → ZnO + H2O
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
D. Zn(OH)2, Ca(OH)2, KOH, NaOH.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
Phương trình phản ứng xảy ra
Cu(OH)2![]() CuO + H2O
CuO + H2O
2Fe(OH)3![]() Fe2O3 + 3H2O
Fe2O3 + 3H2O
Mg(OH)2![]() MgO + H2O
MgO + H2O
Zn(OH)2![]() ZnO + H2O
ZnO + H2O
Câu 3. Cho các thí nghiệm sau
(a) Cho dung dịch AgNO3 vào dung dịch HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Số thí nghiệm thu được chất rắn là
A. 4
B. 2
C. 5
D. 3
(a) đúng tạo AgCl
(b) sai vì Al2O3 tan hết trong HCl
(c) đúng vì Cu không tác dụng với HCl nên còn nguyên sau phản ứng
(d) đúng do tạo kết tủa BaCO3 : Ba(OH)2 + KHCO3 → BaCO3 + KOH + H2O
Vậy có 3 thí nghiệm thu được chất rắn sau phản ứng.
Câu 4. Cặp chất tồn tại trong một dung dịch (chúng không phản ứng với nhau):
A. NaOH và KCl
B. NaOH và HCl
C. NaOH và MgCl2
D. NaOH và Al(OH)3
Cặp chất tồn tại trong một dung dịch (chúng không phản ứng với nhau) là NaOH và KCl
Còn lại đều phản ứng với nhau
B. NaOH và HCl
NaOH + HCl → NaCl + H2O
C. NaOH và MgCl2
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
D. NaOH và Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Câu 5. Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: KCl, Ba(OH)2, KOH, K2SO4. Chỉ cần dùng thêm 1 hóa chất nào sau đây để nhận biết các dung dịch trên?
A. quỳ tím
B. dung dịch HCl
C. dung dịch BaCl2
D. dung dịch KOH
Trích mẫu thử ra ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
Những dung dịch làm quỳ tím đổi màu là: KOH và Ba(OH)2, (nhóm 1).
Những dung dịch không làm quỳ tím đổi màu là: KCl, K2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là K2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng hóa học:
Ba(OH)2 + K2SO4 → BaSO4 + KOH
Câu 6. Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 13,44 lít khí (đktc). Thể tích dung dịch NaOH cần dùng là
A. 200 ml
B. 150 ml
C. 400 ml
D. 300 ml
nH2(đktc) = VH2/22,4 = 13,44/22,4 = 0,6 (mol)
Phương trình phản ứng hóa học
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,4 ← 0,6
Theo phương trình phản ứng hóa học
nNaOH = 2/3nH2 =2/3.0,6 = 0,6 (mol)
→ VNaOH = nNaOH : CM = 0,4 : 1 = 0,4 (lít) = 400 (ml)
Câu 7. Để hoà tan hoàn toàn 13,6 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 0,5M. Giá trị của V là :
A. 1,8.
B. 0,8.
C. 2,3.
D. 1,6.
Vì số mol của FeO và Fe2O3 trong hỗn hợp bằng nhau nên ta quy đổi hỗn hợp FeO, Fe3O4 và Fe2O3 thành Fe3O4.
Ta có = 13,6/233 = 0,05 mol.
nHCl = 2.nO (trong oxit) = 2 . 0,05 .4 = 0,4 (mol)
=> VHCl = 0,4 : 0,5 = 0,8 lít
Câu 8. Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 31,5 gam HNO3, thu được 0,784 lít NO2 (đktc). Dung dịch thu được cho tác dụng vừa đủ với 100 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi thu được 4,88 gam chất rắn X. Nồng độ % của dung dịch HNO3 có giá trị là:
A. 47,2%.
B. 46,2%.
C. 46,6%.
D. 44,2%.
Chất rắn X là Fe2O3
=> nFe2O3 = 4,88/160 = 0,0305 mol
Áp dụng định luật bảo toàn nguyên tố Fe
=> nFe(OH)3 = 2 nFe2O3 = 0.0305. 2 = 0,244 mol
Gọi số mol của Fe3O4, FeS2 lần lượt là x, y (mol)
Áp dụng định luật bảo toàn nguyên tố Fe
=> 3.nFe3O4 + nFeS2 = nFe(OH)3
=> 3x + y = 0,122 (1)
Áp dụng định luật bảo toàn electron
=> nFe3O4 + 15 . nFeS2 = nNO2
=> x + 15y = 0,035 (2)
Từ (1) và (2)
=> x = 0,02; y = 0,002
Áp dụng định luật bảo toàn nguyên tố Na
=> nNaOH = nNaNO3 + 2.nNa2SO4 (3)
nNa2SO4 = 2 . nFeS2 = 0,001 . 2 = 0,002 mol (4)
=> nNaNO3 = 0,02 – 0,002 . 2 = 0,196 (mol)
Áp dụng định luật bảo toàn nguyên tố N là:
nHNO3 = nNaNO3 + nNO2 = 0,196 + 0,35 = 0,231 (mol)
=> C% HNO3 = (0,231 . 31,5):31,5. 100% = 46,2%
Câu 9. Người ta tiến hành điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được, không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch chất gì để bảo quản
A. một lượng sắt dư .
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
Phương trình hóa học
Fe + 2Fe3+ → 3Fe2+
=> Việc thêm Fe sẽ ngăn quá trình Fe2+ bị oxi hóa thành Fe3+
Câu 10. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 1,5 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam.
B. 23,2 gam.
C. 11,6 gam.
D. 34,8 gam.
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4 = nSO42- = naxit = 0,3 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,3 : 3 = 0,1 mol
→ m = 0,1.232 = 23,2 gam.
Câu 11. Hiện tượng xảy ra khi cho dung dịch Na2CO3 vào dung dịch FeCl3 là
A. Chỉ sủi bọt khí
B. Chỉ xuất hiện kết tủa nâu đỏ
C. Xuất hiện kết tủa nâu đỏ và sủi bọt khí
D. Xuất hiện kết tủa trắng hơi xanh và sủi bọt khí
Phương trình phản ứng:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓(đỏ nâu) + 3CO2↑ + 6NaCl
Hiện tượng xảy ra khi cho dung dịch Na2CO3 vào dung dịch FeCl3 là Xuất hiện kết tủa nâu đỏ và sủi bọt khí
Câu 12. Sản phẩm của phản ứng nhiệt phân nào dưới đây là không đúng?
A. NH4Cl → NH3 + HCl
B. NH4HCO3 → NH3 + H2O + CO2
C. NH4NO3 → NH3 + HNO3
D. NH4NO2 → N2 + 2H2O
Sản phẩm của phản ứng nhiệt phân không đúng là:
C. NH4NO3 → NH3 + HNO3
Phương trình nhiệt phân đúng
NH4NO3![]() N2O + 2H2O
N2O + 2H2O
Câu 13. Trong phòng thí nghiệm, tiến hành điều chế H2 bằng cách cho Zn vào dung dịch HCl loãng. Khí H2 sẽ thoát ra nhanh hơn nếu thêm vào hệ phản ứng vài giọt dung dịch nào sau đây?
A. CuCl2
B. NaCl
C. MgCl2
D. AlCl3
Để phản ứng xảy ra nhanh hơn người ta thêm CuCl2 vào vì CuCl2 + Zn → Cu + ZnCl2
→ tạo ra 2 kim loại là Zn và Cu → tạo ra hiện tượng điện hóa học khi 2 kim loại này cũng tác dụng với dung dịch H+ →Zn phản ứng với H+ nhanh hơn
Đáp án cần chọn là: A
Câu 14. Có 4 dung dịch riêng biệt: HCl; CuCl2; FeCl3; HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hoá là
A. 0
B. 1
C. 2
D. 3
Fe + HCl: ăn mòn hóa học vì không hình thành 2 điện cực mới
Fe + CuCl2: ăn mòn điện hóa vì hình thành 2 điện cực Fe và Cu. Hai điện cực tiếp xúc với nhau và tiếp xúc với dung dịch điện li
Fe + FeCl3: ăn mòn hóa học vì không hình thành 2 điện cực mới
Fe + HCl có lẫn CuCl2: cả ăn mòn điện hóa và ăn mòn hóa học vì xảy ra các phản ứng sau
Fe + 2HCl → FeCl2 + H2 (ăn mòn hóa học vì không hình thành 2 điện cực mới)
Fe + CuCl2 → FeCl2 + Cu
→ Cu sinh ra bám vào thanh sắt và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
Câu 15. Để điều chế Fe(OH)2 trong phòng thí nghiệm, người ta tiến hành như sau: Đun sôi dung dịch NaOH sau đó cho nhanh dung dịch FeCl2 vào dung dịch NaOH này. Mục đích chính của việc đun sôi dung dịch NaOH là?
A. Phân hủy hết muối cacbonat, tránh việc tạo kết tủa FeCO3.
B. Đẩy hết oxi hòa tan, tránh việc oxi hòa tan oxi hóa Fe (II) lên Fe (III).
C. Để nước khử Fe (III) thành Fe (II).
D. Đẩy nhanh tốc độ phản ứng.
Để điều chế Fe(OH)2 trong phòng thí nghiệm, người ta tiến hành đun sôi dung dịch NaOH sau đó cho nhanh dung dịch FeCl2 vào dung dịch NaOH này. Mục đích chính của việc đun sôi dung dịch NaOH là : Đẩy hết oxi hòa tan, tránh việc oxi hòa tan oxi hóa Fe(II) lên Fe(III).
Câu 16. Cho các phản ứng chuyển hóa sau:
NaOH + dung dịch X → Fe(OH)2;
Fe(OH)2 + dung dịch Y → Fe2(SO4)3;
Fe2(SO4)3 + dung dịch Z → BaSO4.
Các dung dịch X, Y, Z lần lượt là
A. FeCl3, H2SO4 đặc nóng, Ba(NO3)2.
B. FeCl3, H2SO4 đặc nóng, BaCl2.
C. FeCl2, H2SO4 đặc nóng, BaCl2.
D. FeCl2, H2SO4 loãng, Ba(NO3)2.
Phương trình phản ứng xảy ra
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
dd X
2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O
dd Y
Fe2(SO4)3 + 3BaCl2 → 3BaSO4 + 2FeCl3
dd Z
Câu 17. Khử hoàn toàn 6,64 gam hỗn hợp gồm Fe, FeO, Fe3O4 và Fe2O3 bằng CO dư. Dẫn hỗn hợp khí thu được sau phản ứng vào dung dịch Ca(OH)2 dư thu được 8 gam kết tủa. Khối lượng sắt thu được (gam) sau phản ứng là
A. 4,4.
B. 3,12.
C. 5,36.
D. 5,63.
n kết tủa = nCO2 = 0,08 mol
Phương trình phản ứng hóa học minh họa
FeO + CO → Fe + CO2
Fe2O3 + 3CO → 2Fe + 3CO2
Fe3O4 + 4CO → 3Fe + 4CO2
nO(oxit) = nCO = nCO2 = 0,08 mol
=> mFe = moxit – mO(oxit) = 6,64 – 0,08.16= 5,36 gam
Câu 18. Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
CuO, Fe2O3, ZnO bị bởi khử C, CO, H2 tạo thành Cu, Fe, Zn.
Còn lại MgO.
=> Hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Câu 19. Tiến hành các thí nghiệm sau:
(a) Cho Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch NaOH.
(c) Cho Na2CO3 dư vào dung dịch Ca(HCO3)2.
(d) Cho bột Fe dư vào dung dịch FeCl3.
(e) Hòa tan hỗn hợp rắn gồm Na và Al (có cùng số mol) vào lượng nước dư.
(g) Sục khí Cl2 dư vào dung dịch FeCl2.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm mà dung dịch thu được chỉ chứa một muối tan là
A. 4.
B. 3.
C. 6.
D. 5.
(a) Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Sau phản ứng thu được 2 muối tan là Cu(NO3)2 và Fe(NO3)2.
(b) CO2 + NaOH → NaHCO3
Sau phản ứng thu được 1 muối tan là NaHCO3.
(c) Na2CO3 + Ca(HCO3)2 → CaCO3 + 2NaHCO3
Sau phản ứng thu được 2 muối tan là NaHCO3 và Na2CO3 dư.
(d) Fe dư + 2FeCl3 → 3FeCl2
Sau phản ứng thu được 1 muối tan là FeCl2.
(e) Na + H2O → NaOH + 1/2H2
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Sau phản ứng thu được 1 muối tan là NaAlO2.
(g) Cl2 dư + 2FeCl2 → 2FeCl3
Sau phản ứng thu được 1 muối tan là FeCl3.
Vậy có 4 thí nghiệm mà dung dịch thu được chỉ chứa một muối tan là (b), (d), (e) và (g).
………………………….
>> Mời các bạn tham khảo thêm một số tài liệu liên quan
- Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
- Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
- Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O
- FeSO4 + NaOH → Fe(OH)2 + Na2SO4
Trên đây TaiLieuViet đã giới thiệu Fe(OH)3 → Fe2O3 + H2O tới bạn đọc. Để có kết quả cao hơn trong kì thi, TaiLieuViet xin giới thiệu tới các bạn học sinh tài liệu Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Hóa học, Thi THPT Quốc gia môn Vật Lý, mà TaiLieuViet tổng hợp và đăng tải.
Related posts
Tài liệu nổi bật
Categories
- Âm Nhạc – Mỹ Thuật Lớp 9 (17)
- Âm nhạc lớp 6 – KNTT (31)
- Âm Nhạc Lớp 7- CTST (23)
- Bài tập Toán 9 (8)
- Chưa phân loại (32)
- Chuyên đề Hóa học 12 (196)
- Chuyên đề Sinh học lớp 12 (61)
- Chuyên đề Toán 9 (50)
- Công Nghệ Lớp 10- CD (58)
- Công Nghệ Lớp 10- KNTT (52)
- Công nghệ Lớp 11 – KNTT (22)
- Công Nghệ Lớp 6 – CTST (15)
- Công Nghệ Lớp 6 – KNTT (16)
- Công Nghệ Lớp 7- CTST (18)
- Công Nghệ Lớp 7- KNTT (19)
- Công nghệ Lớp 8 – CD (21)
- Công nghệ Lớp 8 – CTST (18)
- Công nghệ Lớp 8 – KNTT (7)
- Công Nghệ Lớp 9 (114)
- Đề thi học kì 2 lớp 9 môn Văn (35)
- Địa Lí Lớp 10- CD (99)
- Địa Lí Lớp 10- KNTT (77)
- Địa lí Lớp 11 – CD (31)
- Địa lí Lớp 11 – CTST (23)
- Địa lí Lớp 11 – KNTT (19)
- Địa Lí Lớp 12 (134)
- Địa lí Lớp 6 – CTST (36)
- Địa lí Lớp 6 – KNTT (30)
- Địa Lí Lớp 7- CTST (22)
- Địa Lí Lớp 7- KNTT (19)
- Địa Lí Lớp 9 (290)
- GDCD 12 (28)
- GDCD Lớp 6 – CTST (8)
- GDCD Lớp 6 – KNTT (12)
- GDCD Lớp 9 (94)
- Giải bài tập Địa Lí 12 (12)
- Giải bài tập SGK Toán 12 (8)
- Giải bài tập Sinh học 12 (45)
- Giải SBT Hóa học 12 (71)
- Giải vở BT Văn 9 (122)
- Giáo Dục Công Dân Lớp 7- CTST (12)
- Giáo Dục Công Dân Lớp 7- KNTT (10)
- Giáo dục công dân Lớp 8 – CD (10)
- Giáo dục công dân Lớp 8 – CTST (10)
- Giáo dục công dân Lớp 8 – KNTT (10)
- Giáo Dục Quốc Phòng Lớp 10- CD (12)
- Giáo Dục Quốc Phòng Lớp 10- KNTT (12)
- Hóa Học Lớp 10- CD (30)
- Hóa Học Lớp 10- KNTT (61)
- Hoá Học Lớp 11 – CD (19)
- Hoá học Lớp 11 – CTST (19)
- Hoá học Lớp 11 – KNTT (25)
- Hóa Học Lớp 12 (130)
- Hóa Học Lớp 9 (717)
- Hoạt Động Trải Nghiệm Lớp 10- KNTT (52)
- Hoạt Động Trải Nghiệm Lớp 7- CTST (40)
- Hoạt Động Trải Nghiệm Lớp 7- KNTT (16)
- Hoạt động trải nghiệm Lớp 8 – CD (19)
- Hoạt động trải nghiệm Lớp 8 – CTST (9)
- Hoạt động trải nghiệm Lớp 8 – KNTT (18)
- Khoa học tự nhiên Lớp 6 – CTST (46)
- Khoa học tự nhiên Lớp 6 – KNTT (57)
- Khoa Học Tự Nhiên Lớp 7- CTST (51)
- Khoa học tự nhiên Lớp 8 – CD (51)
- Khoa học tự nhiên Lớp 8 – CTST (33)
- Khoa học tự nhiên Lớp 8 – KNTT (37)
- Kinh Tế & Pháp Luật Lớp 10 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CD (21)
- Kinh tế & Pháp luật Lớp 11 – CTST (11)
- Kinh tế & Pháp luật Lớp 11 – KNTT (11)
- Lịch Sử Lớp 10- CD (34)
- Lịch Sử Lớp 10- CTST (20)
- Lịch Sử Lớp 10- KNTT (42)
- Lịch sử Lớp 11 – CTST (13)
- Lịch sử Lớp 11 – KNTT (13)
- Lịch sử Lớp 6 – CTST (21)
- Lịch sử Lớp 6 – KNTT (22)
- Lịch Sử Lớp 7- CTST (19)
- Lịch sử lớp 7- KNTT (18)
- Lịch Sử Lớp 9 (148)
- Lịch sử và Địa lí Lớp 8 – CTST (40)
- Lịch sử và Địa lí Lớp 8 – KNTT (33)
- Lý thuyết Địa lý 12 (4)
- Lý thuyết Lịch sử lớp 9 (33)
- Lý thuyết Ngữ Văn (83)
- Lý thuyết Ngữ Văn 12 (18)
- Lý thuyết Sinh học 12 (41)
- Mở bài – Kết bài hay (55)
- Mở bài lớp 12 hay (24)
- Nghị luận xã hội (34)
- Ngữ Văn Lớp 10- CD (113)
- Ngữ Văn Lớp 10- CTST (79)
- Ngữ Văn Lớp 10- KNTT (198)
- Ngữ Văn Lớp 11 – CD (51)
- Ngữ văn Lớp 11 – CTST (89)
- Ngữ Văn Lớp 11 – KNTT (107)
- Ngữ Văn Lớp 12 (379)
- Ngữ Văn Lớp 6 – KNTT (293)
- Ngữ Văn Lớp 7- CTST (103)
- Ngữ Văn Lớp 7- KNTT (66)
- Ngữ văn Lớp 8 – CD (48)
- Ngữ văn Lớp 8 – CTST (123)
- Ngữ văn Lớp 8 – KNTT (196)
- Ngữ Văn Lớp 9 (28)
- Phân tích các tác phẩm lớp 12 (12)
- Sinh Học Lớp 10- CD (49)
- Sinh Học Lớp 10- CTST (61)
- Sinh Học Lớp 10- KNTT (71)
- Sinh Học Lớp 11 – CD (16)
- Sinh học Lớp 11 – CTST (18)
- Sinh học Lớp 11 – KNTT (18)
- Sinh Học Lớp 9 (229)
- Soạn Anh 12 mới (86)
- Soạn văn 9 (50)
- SOẠN VĂN 9 BÀI 1 (50)
- SOẠN VĂN 9 BÀI 2 (50)
- Tác giả – Tác phẩm (41)
- Tác giả – Tác phẩm Ngữ Văn 12 (13)
- Thi THPT QG môn Địa lý (12)
- Thi THPT QG môn Sinh (8)
- Tiếng Anh Lớp 10 Friends Global (57)
- Tiếng Anh Lớp 10 Global Success (604)
- Tiếng Anh Lớp 10 iLearn Smart World (98)
- Tiếng anh Lớp 11 Friends Global (171)
- Tiếng anh Lớp 11 Global Success (368)
- Tiếng anh Lớp 11 iLearn Smart World (104)
- Tiếng Anh Lớp 12 cũ (168)
- Tiếng Anh Lớp 6 Friends Plus (114)
- Tiếng Anh Lớp 6 Global Success (174)
- Tiếng Anh Lớp 7 Friends Plus (160)
- Tiếng Anh Lớp 8 Friends plus (71)
- Tiếng anh Lớp 8 Global Success (79)
- Tiếng anh Lớp 8 iLearn Smart World (40)
- Tiếng Anh Lớp 9 Mới (211)
- Tin Học Lớp 10- CD (24)
- Tin Học Lớp 10- KNTT (33)
- Tin học Lớp 11 – KNTT (21)
- Tin Học Lớp 6 – CTST (41)
- Tin Học Lớp 6- KNTT (17)
- Tin Học Lớp 7- CTST (14)
- Tin Học Lớp 7- KNTT (16)
- Tin học Lớp 8 – CD (36)
- Tin học Lớp 8 – CTST (10)
- Tin học Lớp 8 – KNTT (5)
- Tin Học Lớp 9 (21)
- Toán 10 sách Chân trời sáng tạo (42)
- Toán Lớp 1 – KNTT (1)
- Toán Lớp 10- CD (44)
- Toán Lớp 10- CTST (39)
- Toán Lớp 10- KNTT (161)
- Toán Lớp 11 – CD (19)
- Toán Lớp 11 – CTST (44)
- Toán Lớp 11 – KNTT (46)
- Toán Lớp 12 (123)
- Toán Lớp 6 – CTST (62)
- Toán Lớp 6 – KNTT (102)
- Toán Lớp 7- CTST (52)
- Toán Lớp 7- KNTT (74)
- Toán Lớp 8 – CD (23)
- Toán Lớp 8 – CTST (21)
- Toán Lớp 8 – KNTT (34)
- Toán Lớp 9 (194)
- Tóm tắt Ngữ văn (16)
- Trắc nghiệm Ngữ Văn (75)
- Trắc nghiệm Toán 9 (61)
- Trải nghiệm hướng nghiệp Lớp 11 – KNTT (8)
- Văn mẫu 12 phân tích chuyên sâu (12)
- Văn mẫu 9 (273)
- Vật Lí Lớp 10- CD (39)
- Vật Lí Lớp 10- KNTT (61)
- Vật Lí Lớp 11 – CD (18)
- Vật lí Lớp 11 – CTST (20)
- Vật lí Lớp 11 – KNTT (26)
- Vật Lý Lớp 9 (217)